Apesar da boa notícia, especialistas dizem que é necessário aguardar mais evidências de que a vacina é realmente segura e efetiva.
Enquanto esses dados não ficam disponíveis, as farmacêuticas se preparam para a demanda e dizem estar prontas para entregar 50 milhões de doses até o final de 2020 e outras 1,3 bilhão de ampolas ao longo de 2021.
Em paralelo a esse planejamento, governos do mundo inteiro conversam com as empresas para garantir seus lotes de vacina. Até o momento, Estados Unidos, Japão, Canadá, Chile, Peru, Costa Rica e alguns países da Europa já firmaram acordos com Pfizer e BioNTech.
E o Brasil? Há alguma negociação
Em julho, a Agência Nacional de Vigilância Sanitária (Anvisa) liberou a realização do estudo clínico de fase 3 da vacina da Pfizer/BioNTech em nosso país.
Em setembro, a entidade autorizou que o número de voluntários fosse duplicado — atualmente, cerca de dois mil brasileiros participam dos testes.
Até o momento, porém, não existem conversas formais entre as duas empresas e o governo federal. Numa entrevista para a revista Veja, publicada no dia 14 de outubro, o CEO da Pfizer no Brasil, Carlos Murillo, disse que a farmacêutica fez contatos, mas não recebeu retorno das autoridades nacionais:
“Em agosto, depois de várias reuniões com integrantes do governo, incluindo do Ministério da Saúde e da Economia, a Pfizer fez uma proposta formal de fornecimento da vacina ao Brasil, sujeita à aprovação regulatória, claro. Essa proposta permitiria vacinar milhões de brasileiros e especificava um prazo para o governo nos responder. Mas nós nunca recebemos uma resposta formal do governo brasileiro, nem pelo sim nem pelo não. Pelo interesse da companhia de tentar fechar um acordo com o Brasil, principalmente por acreditar nos benefícios dessa tecnologia, após ter vencido o prazo, o CEO global da Pfizer mandou uma carta ao presidente Jair Bolsonaro e ao ministro da Saúde retomando a proposta e enfatizando a importância da companhia trabalhar com o Brasil. Tampouco recebemos resposta”, afirmou Murillo à Veja.
Com o silêncio no plano federal, Murillo relata que a empresa decidiu então lidar individualmente com os governos estaduais. Se as negociações forem bem-sucedidas (e, claro, a vacina for aprovada), as primeiras doses só chegariam eventualmente ao Brasil a partir dos primeiros meses de 2021. As entregas de 2020 já estão destinadas para outras partes do mundo.
Procurada pela reportagem da BBC News Brasil, a assessoria de imprensa da Pfizer disse que não houve nenhuma mudança ou novidade em relação aos contatos com o governo federal nas últimas três semanas desde que a entrevista com o CEO foi publicada. O Ministério da Saúde, por sua vez, não respondeu ao contato da BBC até o fechamento desta reportagem.
Nos últimos meses, o Brasil anunciou a compra de doses atrelada à transferência de tecnologia da candidata à vacina desenvolvida pela farmacêutica AstraZeneca e pela Universidade de Oxford, na Inglaterra.
O governo do estado de São Paulo fez uma parceria entre o Instituto Butantan e a chinesa Sinovac para testar e fabricar CoronaVac. Já o Paraná anunciou que produzirá o imunizante Sputnik V, desenvolvido na Rússia.
O Brasil também aderiu ao Covax, um consórcio da Organização Mundial da Saúde (OMS) para custeio e distribuição das futuras vacinas aos países mais pobres. Isso pode garantir que uma parcela da população tenha acesso às doses ao longo de 2021.
Lembrando que todos esses acordos dependem do resultado dos estudos clínicos de fase 3 e da aprovação da Anvisa.
O que o anúncio de hoje significa?
Atualmente, a BNT162b2 (nome provisório da candidata à vacina de Pfizer e BioNTech) é avaliada em 43.538 indivíduos espalhados por seis países (África do Sul, Alemanha, Argentina, Brasil, Estados Unidos e Turquia).
Metade das pessoas recebe as doses, enquanto a outra parte toma um placebo, substância sem nenhum efeito no organismo.
Geralmente, nem os pesquisadores, nem os voluntários, sabem quem faz parte de qual grupo. Todos são acompanhados e, depois de um tempo, os cientistas comparam quantas pessoas acabaram diagnosticadas com covid-19.
A expectativa é que os participantes realmente vacinados tenham se infectado menos com o coronavírus em relação à outra turma. “A partir daí, é possível calcular quantos se protegem e qual é a taxa de eficácia do imunizante”, explica a neurocientista Mellanie Fontes-Dutra, coordenadora da Rede Análise Covid-19.
De acordo com o site ClinicalTrials.Gov, a estimativa é que o estudo de fase 3 da postulante à vacina de Pfizer/BioNTech seja finalizado somente no dia 11 de dezembro de 2022.
Mas, em meio a uma pandemia, não dá pra esperar tanto tempo assim: as empresas podem fazer análises preliminares para ver como seu produto está se saindo. Caso os resultados sejam promissores, já é possível pedir uma aprovação emergencial para as agências regulatórias, como a Anvisa no Brasil e a FDA nos Estados Unidos.
E é exatamente isso que Pfizer e BioNTech estão fazendo: o anúncio de hoje se baseou em dados de 94 voluntários e revelou essa eficácia superior aos 90%. Segundo as informações divulgadas, não foram observados eventos adversos ou outras preocupações nesta etapa.
Como planejado previamente, as empresas esperam atingir a marca de 164 eventos (em outras palavras, 164 participantes diagnosticados com covid-19) para completar essa análise preliminar. Se tudo der certo, o pedido de liberação para uso nos Estados Unidos deve ser feito até o fim de novembro.
Avanços e entraves
Se der tudo certo nos próximos passos, a BNT162b2 representará uma revolução na medicina: ela seria a primeira vacina baseada em RNA a ser aprovada na história.
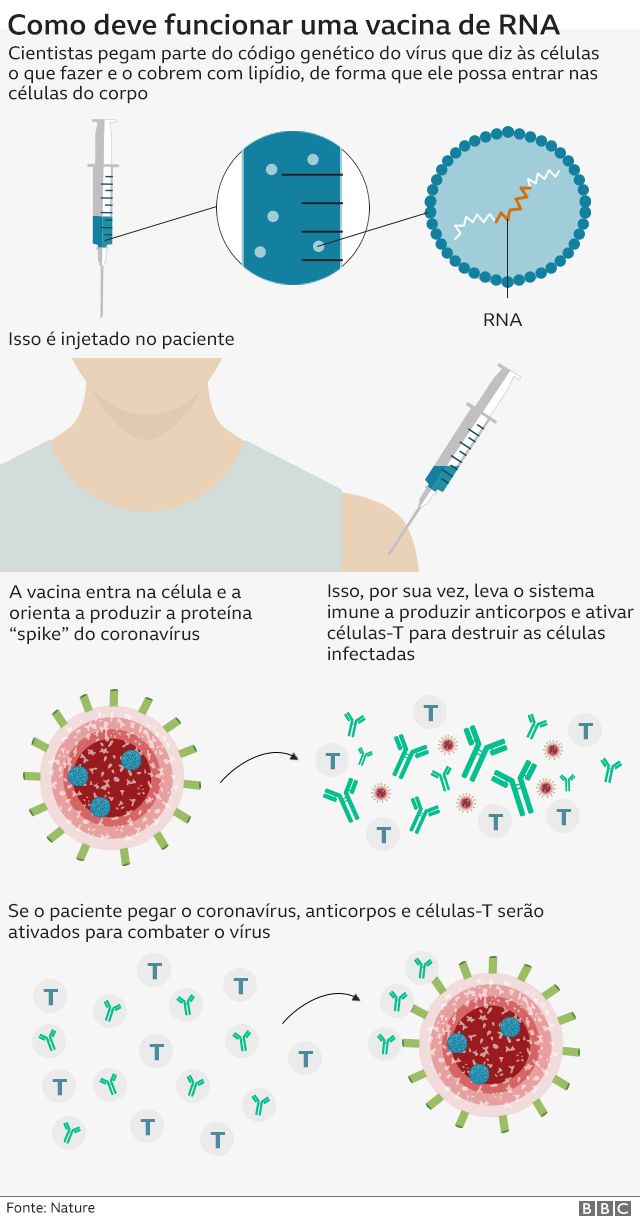
Esse tipo inédito de imunizante carrega um pedaço de material genético modificado em laboratório e passa instruções para que as próprias células do nosso corpo fabriquem proteínas do vírus. A partir daí, o sistema imune reconhece a ameaça e gera uma resposta que protege o organismo da doença de verdade.
“Vale mencionar que esses genes contidos da vacina não têm capacidade de se integrar ao nosso DNA. Essa modalidade de vacinação se mostra muito segura”, completa Fontes-Dutra.
As vacinas disponíveis até o momento são feitas a partir do agente infeccioso inativado ou atenuado, ou com pedacinhos de proteínas dos patógenos.
Do mesmo modo que o produto de Pfizer e BioNTech se destaca pelo ineditismo, há uma grande preocupação a respeito da logística necessária para sua aplicação: para não estragarem, as doses precisam ser refrigeradas a 80°C negativos.
Será necessário inventar todo um aparato capaz de garantir temperaturas tão baixas. Também não se sabe ao certo como será o transporte dessa carga e seu armazenamento em locais com muito calor ou pouco acesso à energia elétrica.
“Essas requisições preocupam a comunidade científica. De fato é algo muito promissor, mas há um desafio grande pela frente. Talvez com essas primeiras vacinas aprovadas, conseguiremos ao menos resguardar a população de risco e os profissionais estratégicos para o enfrentamento da pandemia”, avalia Fontes-Dutra.
Os resultados anunciados hoje foram encarados com muito otimismo. Mas é preciso ter calma e aguardar novos capítulos e mais informações antes de o mundo ter sua primeira vacina capaz de conter a covid-19.
Crédito: André Biernath da BBC News Brasil – @internet 10/11/2020
Vacina contra coronavírus: Pfizer anuncia que testes indicaram 90% de proteção
Uma das vacinas sendo testadas contra o coronavírus é, segundo uma análise preliminar de seus idealizadores, capaz de prevenir que mais de 90% das pessoas desenvolvam a covid-19.
As fabricantes Pfizer e BioNTech descreveram a novidade nesta segunda-feira (9/11) como um “grande dia para a ciência e para a humanidade”.
A vacina foi testada em 43,5 mil pessoas de seis países e, em setembro, a Anvisa (Agência Nacional de Vigilância Sanitária) autorizou que seus testes clínicos fossem ampliados no Brasil, de mil para dois mil testes em voluntários.
Segundo as fabricantes, nenhum problema de segurança na vacina foi levantado até o momento
As empresas planejam solicitar, até o final deste mês, uma aprovação emergencial para uso da vacina, na expectativa de que a imunização ajude os países a reduzir as medidas de restrição de circulação em vigor.
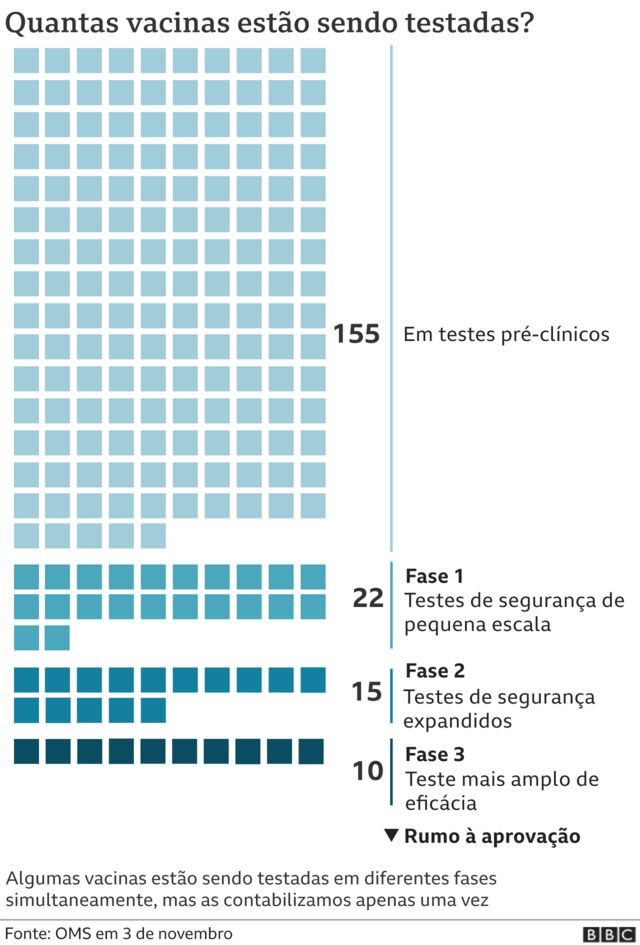
Há cerca de uma dúzia de vacinas contra a covid-19 nas fases finais de testagem (chamadas de fase 3), mas essa é a primeira a apresentar resultados efetivos relacionados à prevenção. No Brasil, outra vacina em desenvolvimento, a CoronaVac, pelo Instituto Butantan, está justamente na etapa de investigar se ela é capaz de proteger contra a covid-19, depois de testes prévios terem indicado que ela é segura.
A vacina da Pfizer é diferente porque usa uma abordagem completamente experimental: envolve injetar parte do código genético do vírus de modo a treinar o sistema imunológico do indivíduo.
Testes prévios apontaram que a vacina treina o corpo a fazer tanto anticorpos quanto, em outra parte do sistema imune, as chamadas células T para combater o coronavírus.
São necessárias duas doses da vacina, com três semanas de diferença entre elas. Os testes (feitos, além do Brasil, em Alemanha, EUA, Argentina, África do Sul e Turquia) apontaram uma proteção de 90% depois da segunda dose.
No entanto, é importante destacar que ainda não se sabe qual a duração dessa imunidade.
As fabricantes afirmam que serão capazes de prover 50 milhões de doses ao final deste ano e 1,3 bilhão até o fim de 2021.
Mas há desafios logísticos importantes para isso: as vacinas precisam ser armazenadas em refrigeradores ultrafrios, a menos 80°C.
OMS: Notícia é boa, mas ‘não vai virar o jogo’
Questionado pela BBC sobre o avanço, o enviado especial da OMS (Organização Mundial da Saúde) de covid-19, David Nabarro, afirmou que se trata de uma ótima notícia, mas que a vacina, “embora ajude, não vai virar completamente o jogo” na pandemia.
Ele afirmou que a vacina ainda terá de passar pelos processos regulatórios e que ainda há “muitos passos” antes que autoridades possam atestar com segurança que a imunização é “segura e eficiente”, o que ainda pode levar alguns meses.
Nabarro também pediu que, mesmo que a vacina seja aprovada, as pessoas mantenham as medidas de segurança e isolamento social para impedir a circulação do coronavírus.
“Quero reforçar que esses princípios continuam sendo absolutamente essenciais mesmo que uma vacina chegue nos próximos meses”, declarou.
Já o professor emérito de Medicina da Universidade de Oxford John Bell afirmou à BBC que a notícia lhe trouxe confiança de que a vida poderá voltar à normalidade na primavera do hemisfério Norte, ou seja, no final do primeiro trimestre do ano que vem.
Outro professor da mesma universidade, Peter Horby, afirmou que o anúncio desta segunda-feira o fez “sorrir de orelha a orelha”.
“É um alívio. (…) Ainda temos um longo caminho até que as vacinas comecem a fazer uma diferença real, mas este parece ser um divisor de águas”.
Resultados são preliminares
Os dados apresentados pela Pfizer ainda não são finais: são baseados nos testes com 94 voluntários que desenvolveram covid-19.
A porcentagem da eficiência exata da vacina pode, portanto, mudar quando os resultados completos forem divulgados.
As empresas afirmam que esses dados podem estar prontos nas próximas semanas, quando seria possível encaminhar a vacina para os órgãos reguladores.
Até lá, não é possível iniciar campanhas de vacinação nos países.
Em reação à notícia, as bolsas do mundo inteiro subiram a níveis históricos na manhã desta segunda-feira.
O índice britânico FTSE subiu 5%, em seu melhor dia desde março, e os mercados acionários da França e da Alemanha alcançaram marcas semelhantes.
Um dos destaques foi a alta nas ações de empresas aéreas, ante a perspectiva de que uma vacina possa permitir uma retomada do setor.
No Brasil, o Ibovespa estava em alta de mais de 3,5% na manhã de segunda.
Crédito: James Gallagher da BBC News – @internet 10/11/2020














